Espermograma basico, morfologia, y swim–up diagnostico/fragmentación del ADN espermático: test de tunel.
Básicamente permite observar cantidad, movilidad, y forma de los espermatozoides. Forma parte del conjunto de análisis iniciales en la evaluación de la pareja infértil.
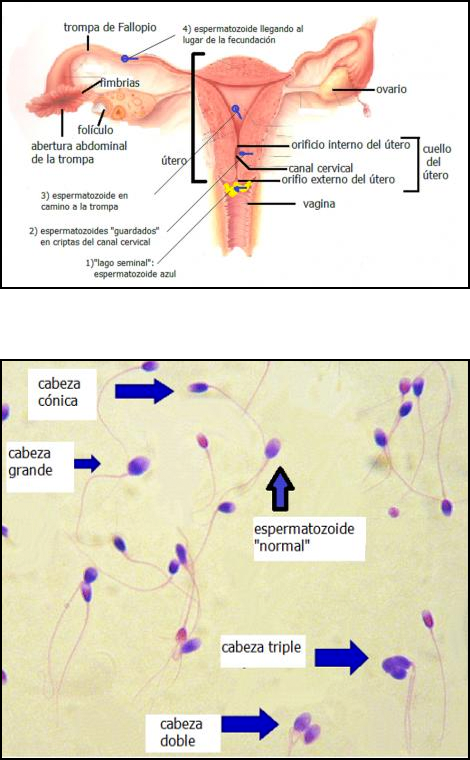
Es necesario cierto volumen mínimo para la formación del "lago seminal".
Para la concepción natural in vivo, los espermatozoides deben ser depositados alrededor del orificio cervical externo formando el “lago seminal” durante el período peri-ovulatorio cuando el moco cervical está receptivo a la penetración de los espermatozoides. Para la formación de dicho “lago” es necesario que la muestra tenga un volumen adecuado.
Para que el embarazo pueda darse en forma espontánea se considera que debe existir un número mínimo de espermatozoides en el eyaculado. De todos modos, a pesar de los valores de referencia estipulados, la cantidad de espermatozoides necesaria para obtener un embarazo varía mucho y depende de cada pareja.
Se ha acordado como valor de referencia 20 millones/ml de semen ó más (el límite inferior del valor de referencia sería 15 millones/ml, OMS 2010; Comité de Práctica de la Sociedad Americana de Medicina Reproductiva, Fertil Steril 2012) . Sin embargo la importancia del número de espermatozoides está sobreestimada; se ha demostrado en parejas con 6 meses de infertilidad que el 62% obtuvo embarazo en el plazo de un año cuando la cantidad de espermatozoides fue mayor ó igual a 5 millones por ml; también se ha probado paternidad en hombres vasectomizados sin espermatozoides detectables en el eyaculado.
La movilidad de los espermatozoides nos indica en primer lugar que se encuentran vivos; además aquellos que más rápido y más progresivamente se muevan tendrán mayores posibilidades de llegar al óvulo y fecundarlo.
La buena movilidad está directamente relacionada con la capacidad fecundante.
Se ha establecido una correlación positiva entre morfología espermática y capacidad de fecundación; esto no siempre es así. Vemos con frecuencia (por Fecundación In Vitro) como sémenes con bajos porcentajes de espermatozoides normales tienen excelentes tasas de fecundación, embarazo, y nacimiento de bebés sanos.
La variabilidad de formas del espermatozoide humano hace difícil la evaluación de la morfología; a pesar de ello, la apariencia del espermatozoide normal se pudo definir a partir de la observación de espermatozoides recuperados desde el moco cervical o desde la superficie de la zona pelúcida del óvulo (Fredricsson & Bjork, 1977; Mortimer et. al., 1982; Menkveld et al., 1990; Liu & Baker, 1992).
Un espermatozoide sin “defectos morfológicos” se considera morfológicamente “normal”; se ha sugerido que el término “normal” sea reemplazado por “típico”. Un espermatozoide típico ó “normal” tiene una cabeza ovalada y una cola que no está quebrada ni enrollada. Los espermatozoides “anormales” ó atípicos pueden tener cabezas grandes ó muy chicas, doble cabeza, múltiples colas, colas quebradas, etc. El significado de la existencia de espermatozoides con defectos en su morfología no está totalmente entendido.
En la última edición (2010), la OMS, ha adoptado el 4% de formas normales como valor de corte en un eyaculado normal. Esto está basado en el trabajo científico de los doctores TF Kruger y R Menkeveld en el Hospital Tygerberg en Sudáfrica. La validez científica de éste sistema se basa en el hecho de que antes se había tomado como valor normal aquel que surgía del estudio de muestras de semen competentes; en cambio, el nuevo valor de corte surge de haber considerado las muestras de una población de hombres que dejaron embarazadas a sus parejas en menos de un año.
A continuación se muestra una tabla con los límites inferiores de los valores de referencia aceptados publicada por el Comité de Práctica de la Sociedad Americana de Medicina Reproductiva, Fertil Steril 2012.
Lower limits of the accepted reference values for semen analysis.
On at least two occasions Reference value
Ejaculate volume 1.5 mL
pH 7.2
Sperm concentration 15 millions spermatozoa/mL
Total sperm number 39 millions spermatozoa/ejaculate
Percent motility 40%
Forward progression 32%
Normal morphology 4% normal
And
Sperm agglutination absent
Viscosity %2 cm thread post-liquefaction
Note: Data taken from World Health Organization, 2010.
Practice Committee. Evaluation of the infertile male. Fertil Steril 2012
El swim-up ó "lavado" de la muestra de espermatozoides consiste en una suspensión de los "mejores" espermatozoides. La calidad de éste lavado orientará al médico en la elección del tratamiento a seguir por la pareja infértil.
La fragmentación del ADN espermático hace referencia a lesiones en el material genético del espermatozoide (ADN). Existen varios métodos para medir los niveles de fragmentación del ADN espermático, el test de TUNEL es uno de ellos. Este estudio está indicado en hombres con varicocele, edad avanzada (>45 años), fumadores, fallas de fertilización, embriones de mala calidad, etc.
La fragmentación del ADN espermático ha sido asociada con abortos espontáneos y fallas de implantación; estos datos aún se discuten, por ésta razón no se recomienda la indicación de éste análisis en el estudio inicial de la pareja infértil, en forma de rutina (Practice Committee of the American Society for Reproductive Medicine. FertilSteril, vol 98, No.2, August 2012; 294-301; Drobnis et al, 2015 Drobnis E Z., Johnson M H. Are we ready to incorporate sperm DNA-fragmentation testing into our male infertility work - up? A plea for more robust studies. RBMOnline 2015; 30:111-112).
Se debe considerar además que los óvulos tienen capacidad para reparar el ADN fragmentado de los espermatozoides y que el método empleado para procesar el semen en los tratamientos de Reproducción Asistida (gradientes de densidad) reduce significativamente el % de fragmentación del ADN espermático.
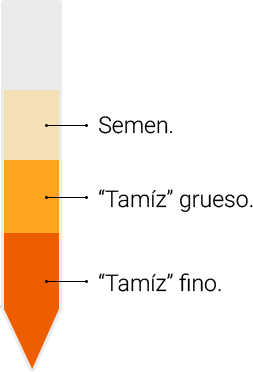

La inseminación intrauterina (IIU) es la primera línea de tratamiento en parejas en que la infertilidad se debe a problemas cervicales, disfunciones ovulatorias, endometriosis leves, factor tubario unilateral, y factores masculinos leves ó moderados. También se usa para el tratamiento de la esterilidad sin causa aparente.
Consiste en la introducción de una suspensión de espermatozoides seleccionados en el interior del útero de la paciente justo en un momento cercano a la ovulación.
Es decir que se hace coincidir en el tiempo ovulación e inseminación y, además se "puentean" vagina y cuello (a veces el moco del cuello del útero puede ser un obstáculo para la llegada de los espermatozoides al óvulo) del útero de modo de acercar espacialmente óvulos y espermatozoides.
De éste modo se aumentan las posibilidades de "encuentro" entre ambas gametas.
Consiste en estimular a los ovarios para que en ése ciclo desarrollen un número mayor de óvulos. Para esto se emplea medicación: gonadotrofinas.
Los óvulos se desarrollan en los ovarios dentro de estructuras similares a globos que llamamos folículos. Los óvulos son de tamaño microscópico y por tanto no pueden verse ecográficamente, lo que sí podemos ver mediante ecografías son los folículos que los contienen. "Mirando" ecográficamente cómo va aumentando el tamaño de los folículos a medida que pasan los días del ciclo y gracias a la medicación usada, podremos conocer el desarrollo de los óvulos en los ovarios; podremos estimar su número y su grado de maduréz.
También se puede medir el nivel de estrógeno circulante, que está relacionado con el número y tamaño de los folículos.
Cuando uno o más folículos están maduros (más de 17 mm), se indica a la paciente la aplicación de una inyección de gonadotrofina coriónica (hCG) para acelerar la maduración y liberación de los óvulos del interior de los folículos.
La ovulación (liberación de los óvulos desde el interior de los folículos) ocurre a las 36 horas de la administración de hCG, por ésta razón, una vez indicadas fecha y hora de aplicación de hCG también quedarán definidas fecha y hora de la inseminación.
Para seleccionar los espermatozoides que serán usados en una inseminación intrauterina (también en FIV e ICSI) usamos una suspensión de partículas muy concentrada que funciona como un tamíz ó colador fino y otra suspensión de partículas menos concentrada que funciona como tamíz ó colador grueso. Se colocan por ej 0,5 ml de la suspensión más concentrada en el fondo de un tubo de centrífuga y luego 0,5 ml de la suspensión más diluída: así se forman 2 capas ó dos “tamices” con distinto tamaño de poro (éstas capas no se mezclan). Sobre éstas dos capas se coloca el semen. El tubo se centrifuga con lo cual los espermatozoides son forzados a ir hacia el fondo del tubo debiendo atravesar 2 coladores ó tamices. Primero, atraviesan el colador grueso y allí ya quedan retenidos muchos espermatozoides y células, luego pasan por el colador fino en el cual quedan retenidos otros espermatozoides. Finalmente, los espermatozoides que lograron atravesar los dos filtros (coladores ó tamices) son los seleccionados para el tratamiento: los de mejor movilidad y morfología. Ver imagen.
Los espermatozoides seleccionados se resuspenden en 0,5 – 0,7 ml de un medio de cultivo que contiene sales, glucosa, aminoácidos, albúmina, y antibióticos. Esta suspensión contiene comúnmente una concentración de espermatozoides mayor a la de la muestra original (ya que al partir de una muestra de 2 – 4 ml y resuspender los espermatozoides seleccionados en sólo 0,5 – 0,7 ml se aumenta la concentración de los mismos) y un % mucho mayor de espermatozoides móviles progresivos.
Nota: éste método también se hace en forma diagnóstica. La calidad de la suspensión de espermatozoides seleccionados ayudará al médico a decidir el tratamiento adecuado para una pareja.
Consiste en colocar los espermatozoides seleccionados en la cavidad uterina, para ello se emplea un catéter en el cual se carga la suspensión de espermatozoides. Este procedimiento se realiza en el consultorio, es rápido e indoloro.
A partir del momento de la inseminación se indica el uso de progesterona que actuará a nivel del endometrio (capita de tejido que reviste interiormente al útero) para favorecer la implantación del embrión.
La prueba de embarazo se realiza 12 - 15 días después de la inseminación.